Скачай приложение iTest
Готовься к школьным экзаменам в более удобном формате
Насыщенные углеводороды
Предельные углеводороды (алканы). Номенклатура алканов и их производных
Углеводороды – это простейшие органические соединения, которые состоят из двух элементов – углерода, водорода.
Предельные углеводороды, или алканы. (международное название), – это соединения, состав которых выражается общей формулой \(C_nH_{2n+2}\), где n – число атомов углерода.
Особенности предельных углеводородов (алканов):
1) в молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью;
2) остальные валентности насыщены атомами водорода;
3) алканы также называются насыщенными углеводородами, или парафинами;
4) первым членом гомологического ряда алканов является метан \((CH_4)\);
5) начиная с пятого углеводорода название образуется от греческого числительного, которое указывает число углеродных атомов в молекуле;
6) в гомологическом ряду наблюдается изменение физических свойств углеводородов: а) повышаются температуры кипения и плавления; б) возрастает плотность;
7) алканы начиная с четвертого члена ряда (бутана) имеют изомеры.
Номенклатура алканов и их производных.
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называются углеводородными радикалами.
Радикалы образуются не только органическими, но и неорганическими соединениями.
Если отнять от молекулы углеводорода два атома водорода, получаются двухвалентные радикалы.
Для названия изомеров применяются две номенклатуры: 1) рациональная – старая; 2) заместительная (систематическая или международная) – современная. Предложена Международным союзом теоретической и прикладной химии ИЮПАК.
Особенности рациональной номенклатуры: 1) по рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы; 2) рациональная номенклатура удобна для не очень сложных соединений.
Особенности заместительной номенклатуры: 1) по заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители; 2) если в формуле содержится несколько одинаковых радикалов, то перед их названием указывается число прописью, а номера радикалов разделяются запятыми.
Химические свойства метана и его гомологов
Основные свойства метана:
1) это газ без цвета и запаха \((CH_4)\);
2) в два раза легче воздуха;
3) образуется в природе в результате разложения без доступа воздуха остатков животных и растительных организмов;
4) может быть обнаружен в заболоченных водоемах, каменноугольных шахтах;
5) содержится в природном газе, который широко используется в качестве топлива в быту и на производстве;
6) в молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер.
Молекула метана имеет тетраэдрическую форму, а не плоскую.
Когда атом углерода вступает во взаимодействие с атомами водорода, s-электроны наружного слоя в нем распариваются, один из них занимает вакантное место третьего р-электрона и образует при своем движении облако в виде объемной восьмерки, перпендикулярное по отношению к облакам двух других р-электронов.
Атом при этом переходит в возбужденное состояние. Все четыре валентных электрона становятся неспаренными, они могут образовывать четыре химические связи.
Противоречия: 1) три р-электрона должны образовывать три химические связи с атомами водорода во взаимно перпендикулярных направлениях (под углом 90°); 2) четвертый атом водорода мог бы присоединяться в произвольном направлении.
Разрешение противоречий: 1) в процессе образования химических связей облака всех валентных электронов атома углерода (одного s– и трех р-электронов) выравниваются, становятся одинаковыми; 2) облака принимают форму несимметричных, вытянутых в направлении к вершинам тэтраэдра объемных восьмерок. Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую; 3) угол между осями гибридных электронных облаков равен 109°, что позволяет им максимально удаляться друг от друга; 4) такие облака могут значительно перекрываться электронными облаками водородных атомов, что ведет к большому выделению энергии и образованию прочных, одинаковых по свойствам химических связей.
Гибридизация может распространяться на разное число электронных облаков.
Шаростержневая модель молекулы:
1) детали, изображающие атомы, соединяются на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи; 2) модель дает наглядное представление о том, какие атомы с какими соединены, но она не передает относительных размеров и внешней формы молекулы.
Строение и номенклатура углеводородов ряда метана
Строение углеводородов.
Предельные углеводороды (неразветвленного строения): 1) метан; 2) этан; 3) пропан; 4) бутан; 5) пентан; 6) гексан; 7) гептан; 8) октан; 9) нонан; 10) декан.
С увеличением молекулярной массы последовательно возрастают температуры плавления и кипения углеводородов.
Первые четыре вещества (С1 – С4) при обычных условиях – газы.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях.
Общая формула углеводородов: \(C_{n}H_{2n+n}\), где n – число атомов углерода в молекуле.
Пространственное и электронное строение молекул пропана и бутана.
Атомы углерода в них расположены не по прямой линии, а зигзагообразно.
Причина – в тетраэдрическом направлении валентных связей атомов углерода.
Если к одному атому углерода присоединился другой атом углерода, то у этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра. Следующий атом углерода может присоединиться только в одном из этих направлений.
Углеродная цепь неизменно принимает зигзагообразную форму.
Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана, 109°28′.
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы.
Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг простых сигма-связей.
Углеродная цепь получается сильно изогнутой. Если повернуть атом углерода, то молекула примет почти кольцеобразную форму.
Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов).
Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга.
Все эти разновидности легко переходят одна в другую, при этом их химическое строение (последовательность связи атомов в молекулах) остается неизменным.
Свойство атомов углерода соединяться друг с другом в длинные цепи связано с положением элемента в Периодической системе Д.И. Менделеева и строением его атомов.
При химической реакции у атома углерода трудно полностью оторвать четыре валентных электрона, а также присоединить к нему столько же элетронов от других атомов до образования полного октета.
Химические свойства предельных углеводородов
1. Горение углеводородов на воздухе и выделение большого количества теплоты.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2. Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении \(1:2\). Оптимальное отношение объемов при взрыве метана с воздухом \(1:10\).
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3. При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4. Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается ковалентная связь и образуется молекула хлороводорода.
Применение и получение предельных углеводородов
Сферы применения предельных углеводородов:
1) метан в составе природного газа находит все более широкое применение в быту и на производстве;
2) пропан и бутан применяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метан как доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метана используется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан – основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана: 1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана: 1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов: 1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана: 1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500°C; 5) для разложения метана необходима температура 1000°C.
Бензол и его строение
Физические свойства: 1) бензол – легкокипящая, бесцветная, не растворимая в воде жидкость; 2) он имеет своеобразный запах; 3) при охлаждении бензол легко застывает в белую кристаллическую массу; 4) температура его плавления 5,5°C; 5) формула бензола С6Н6; 6) это сильно ненасыщенное соединение: в молекуле его недостает восемь атомов водорода до состава, отвечающего формуле предельных углеводородов; 7) при этом если взболтать бензол с бромной водой или раствором перманганата калия, то не обнаружится характерных реакций непредельных соединений.
Проблема строения бензола.
1. Бензол может быть получен при пропускании ацетилена через трубку с активированным углем, нагретым до 650°C.
2. Сравнивая состав молекул ацетилена С2Н2 и бензола С6Н6, можно прийти к выводу, что из каждых трех молекул ацетилена образуется одна молекула бензола, т. е. идет реакция полимеризации (тримеризации).
3. Если смесь паров бензола с водородом пропускать через нагретую трубку с катализатором, то оказывается, что: а) к каждой молекуле бензола присоединяются три молекулы водорода; б) в результате реакции образуется циклогексан, строение которого хорошо известно.
4. Присоединение к молекуле бензола трех молекул водорода с образованием циклогексана можно понять только в том случае, если признать, что исходный продукт имеет циклическое строение.
То есть если бы бензол имел незамкнутую цепь углеродных атомов, то молекула его до полного насыщения присоединяла бы не три, а четыре молекулы водорода: \(C_6H_6+4H_2 \rightarrow C_6H\), что противоречит опыту.
Образование циклической молекулы бензола из трех молекул ацетилена можно представить следующим образом:
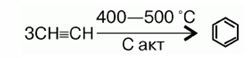
Так можно прийти к выводу о циклической структурной формуле бензола.
Приведенная структурная формула бензола была предложена впервые немецким ученым А. Кекуле (1865 г.).
Более столетия химики пользовались этой формулой, хотя она их и не вполне удовлетворяла.
Электронное строение бензола.
1. Современными физическими методами было установлено, что молекула бензола имеет циклическое строение и что все шесть атомов углерода лежат в одной плоскости.
2. Было подтверждено, что порядок соединения атомов правильно отображается формулой Кекуле.
-
Укажите продукт реакции Вюрца с 2-бромгексаном.
-
Укажите реакцию обрыва цепи при бромировании метана
-
В природном газе объемом 20 л (н. у.) содержатся равные объемные доли метана и этана. Сколько требуется объема воздуха (доля кислорода 20%) для сжигания такого природного газа?
-
Назовите углеводородный газ, если для полного сжигания его одного объема понадобилось 25 объемов воздуха (содержание в нем кислорода принять равным 20%).
-
Вычислите сумму всех коэффициентов в уравнениях, составленных по следующей схеме:
Бутан \(\xrightarrow{t^0}\) Алкадиен \(\xrightarrow{Br_2(изб.)}\) Бромпроизводное алкана -
Для получения 108 г бутадиена -1,2 необходим бутан массой
-
К алканам относится углеводород
-
Молекулярная формула углеводорода, если в состав 3 его молей входит 1,26 – 10\(^{25}\) атомов углерода и 2,88 · 10\(^{25}\) атомов водорода
-
При симметричном крекинге некоторого органического вещества образуется углеводород, в результате полимеризации которого получают полимер (Мr = 21 · 10\(^5\)) со степенью полимеризации 5 · 10\(^4\). Какое это органическое вещество?
-
Для сжигания 35 г циклоалкана с плотностью по азоту - 2,5 требуется воздух (объемная доля кислорода в воздухе 20%, н. у.) объемом
-
В природном газе объемом 40 л (н. у.) содержатся равные объемные доли метана и этана. Сколько требуется объема воздуха (доля кислорода 20%) для сжигания такого природного газа?
-
При сжигании 14 г циклоалкана с плотностью по азоту – 2,5 выделяется углекислый газ (при н. у.) объемом
-
Чему равна масса 2-процентной бромной воды, если при пропускании через нее продуктов крекинга 89,6 л бутана (н. у.) она может обесцветиться?
-
Известно, что в 4 молях некоторого углеводорода содержатся 1,2 · 10\(^{25}\) атомов углерода и 2,88 · 10\(^{25}\) атомов водорода. Определите его молекулярную формулу.
-
Какой объем воздуха (н. у.) в литрах (объемная доля кислорода 0,2) потребуется при сжигании 1,44 кг пентана?
-
В ходе симметричного крекинга 40 л паров гексана (н. у.), в составе которого содержится 20% примесей, был получен продукт с наименьшей молярной массой и практическим выходом 80%. Назовите и определите объем этого продукта.
-
Циклоалкан
-
Известно, что в 5 молях углеводорода содержится 9,0 · 10\(^{24}\) атомов углерода и 2,4 · 10\(^{25}\) атомов водорода. Какова его молекулярная формула?
-
Масса бутана, подвергшегося симметричному крекингу, равна 580 г. Чему равна масса брома, необходимого для реакции присоединения с продуктами?
-
Чему равна масса прореагировавшего пентана, если выход составляет 50%, а масса полученного циклопентана равна 35 г?
-
168 л углекислого газа выделилось при сжигании пентана объемом (н. у.)
-
При обработке избытком известковой воды продукта полного сгорания 11,2 л (н. у.) пропана образовалось 120 г осадка. Чему равен выход соли?
-
При сгорании 56 л пропана, содержащего 20% негорючих примесей, выделяется n-ное количество диоксида углерода (IV). Сколько требуется объема (н. у.) природного газа (80% \(CH_4\), 10% \(SO_2\), 10% \(N_2\)) для получения такого же количества диоксида углерода?
-
При взаимодействии 75,75 г хлорметана с металлическим натрием образуется этан объемом (н. у.)
-
При взаимодействии 6,5 г цинка с 2,26 г дихлорпропана выделяется пропен объемом (н.у.)
-
В цепочке превращений \(C_3H_8\rightarrow C_3H_6 \rightarrow C_3H_7OH\) выход продуктов составляет в первой ступени 80%, а во второй – 75%. Чему равна масса пропанола, полученного из 132 г пропана?
-
Определите вещество Z.
Ацетилен \(\xrightarrow{H_2}X \xrightarrow{HCl}Y{{2Na}\over{-2NaCl}} Z\) -
С ацетиленом не взаимодействует
-
Гомологом пропена является
-
Изомерами пентена-2 являются
-
К алканам относятся
-
Дана схема превращений:
этан \(\xrightarrow{x}\) хлорэтан \(\xrightarrow{y}\) этанол.
В заданной схеме веществами Х и У являются
-
Укажите алкены, имеющие молярные массы 42 г/моль, 56 г/моль, 84 г/моль соответственно.
-
Укажите реакции получения бензола.
-
Газообразными углеводородами при комнатной температуре являются
-
К алканам относится
-
Вещества A, C, D в цепочке превращений \(C_3H_6\overset{Cl_{2,свет}}{\longrightarrow}A\overset{H_2SO_4,t=140^{\circ}C}{\longrightarrow}\)\(C\overset{HBr}{\longrightarrow}D\)